Raccogliendo materiale per questo articolo ho avuto la netta impressione che il dibattito riguardo alle ultime frontiere della manipolazione genetica sia pericolosamente arido. Che si tratti di mia incapacità di individuare le fonti utili? Possibile, eppure ho potuto verificare che le più recenti prese di posizione ufficiali da parte delle maggiori autorità in materia a livello nazionale e internazionale risalgono, nel migliore dei casi, a sei anni fa. Nel campo della ricerca scientifica, nell’era del Prometeo scatenato (si veda Jonas a riguardo), corrispondono ad anni luce. Questa constatazione non ha fatto altro che accrescere il mio desiderio di fare luce, seppur brevemente, sulla storia e i più recenti sviluppi nell’ambito specifico dell’applicazione della tecnica CRISPR-Cas9 agli esseri umani.
Contesto storico e linguistico
La manipolazione del DNA non è affatto una novità: a partire dagli anni Settanta del secolo scorso si parla di tecnica del DNA ricombinante che consente, tramite l’uso di enzimi (proteine) di restrizione, di “tagliare” una sequenza di DNA e, per mezzo di un vettore (tendenzialmente un batterio o un virus resi innocui), di introdurne un tratto o sostituirne uno preesistente. Da allora sono state numerose le applicazioni in campo agricolo, farmacologico e le sperimentazioni sugli animali, ma la questione etica, oltre al fattore di rischio biologico, pesa come una spada di Damocle sui ricercatori non appena si parla di applicazioni agli esseri umani. Allo scopo di alleggerire il carico delle implicazioni etiche e affrontare la questione in maniera più sistematica, la comunità scientifica tende quasi unanimemente ad aggrapparsi alla distinzione tra ricerca di base e ricerca clinica. Con la seconda si intende generalmente una ricerca applicata a fini terapeutici al paziente, con conseguenze concrete sulla sua salute; con la prima, invece, una ricerca che, nelle proprie sperimentazioni e valutazioni non coinvolge in alcun modo il paziente ed è finalizzata esclusivamente ad approfondire la conoscenza di un processo biologico.
Nel documento “L’editing genetico e la tecnica CRISPR-Cas9: considerazioni etiche” del 2017, il CNB (Comitato Nazionale per la Bioetica) si chiede, tuttavia, come istituzione, se questa opposizione non sia obsoleta e ancora legata alla contrapposizione più morale che scientifica tra laici e cattolici sulla liceità della sperimentazione sugli esseri umani (argomento fulcro del documento e di questo articolo) e se questo non inquini il dibattito. Il CNB si chiede inoltre se quest’ultima definizione di “ricerca di base” non strida col concetto stesso di ricerca scientifica, che per sua natura dovrebbe avere la finalità produrre conoscenze utili per contribuire al miglioramento della condizione umana e, in questo caso, della salute. Come pena, in assenza di tale prospettiva, il rischio di risultare autoreferenziale e di sollevare così forti interrogativi sul senso dell’investimento che le viene destinato.
Alla luce di queste considerazioni e per evitare di arenarsi in poco fruttuose dissertazioni linguistiche, il Comitato propone una diversa dicotomia sovrapponibile alla prima ma priva di implicazioni morali, ossia quella tra sperimentazione in vitro e in vivo. Di seguito ci concentreremo sulle implicazioni della seconda.
La svolta della CRISPR-Cas9
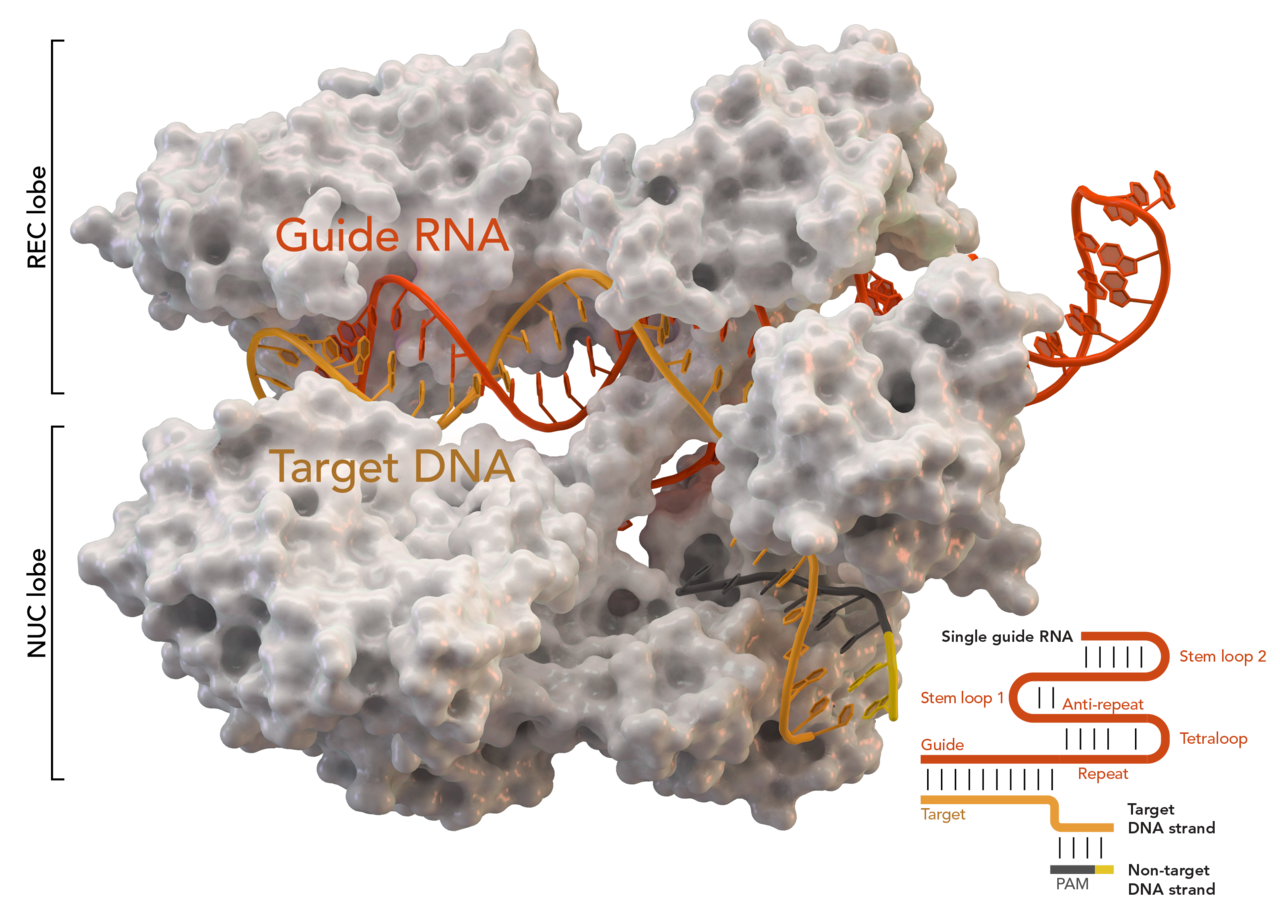
Per comprendere perché, negli ultimi anni, la questione abbia destato una particolare e rinnovata preoccupazione a livello sia medico che etico è a mio avviso necessaria un’ulteriore premessa. In seguito alla messa a punto, nel 2012, da parte delle ricercatrici Charpentier e Doudna (premi Nobel per la chimica nel 2020), della tecnica di gene editing conosciuta come CRISPR-Cas9, si è aperta la strada per la possibilità concreta di modificare il genoma umano con un livello di precisione prima di allora anche solo difficilmente immaginabile. Ciò implica, a livello teorico, il poter correggere alla base mutazioni genetiche che determinano l’insorgenza di numerose malattie anche gravi.
Il nuovo procedimento sfrutta un meccanismo simile a quello del DNA ricombinante, ma usando una molecola di RNA sintetizzata ad hoc (complementare, dunque, alla sequenza di basi d’interesse e quindi capace di interagire con essa in maniera esclusiva) per guidare le “forbici molecolari” sul sito target, anziché fare direttamente uso degli enzimi di restrizione come in precedenza, il che ha semplificato e reso più accessibile ed efficace la manipolazione.
Le nuove sfide
A questo punto si impone un’ulteriore distinzione fondamentale, ossia quella tra editing somatico e germinale. Il primo consiste nella modificazione delle cellule somatiche, ovvero tutte le cellule del corpo esclusi i gameti (spermatozoi e ovociti), le cui informazioni genetiche non verranno trasmesse alla prole. Al contrario, le modificazioni sui gameti o, a livello embrionale, su cellule non ancora specializzate (staminali), determinano la trasmissione dell’informazione al nuovo organismo. Allo stato attuale, tuttavia, risulta estremamente difficile garantire che l’informazione introdotta tramite manipolazione genica venga ereditata e si esprima in maniera omogenea in tutte le cellule del feto o che non avvengano modificazioni off-target (al di fuori del sito d’interesse) con possibili conseguenze di salute anche gravi.
Per questo, a partire dagli anni Novanta, sono stati pubblicati diversi documenti che affermano quasi all’unanimità la necessità di una moratoria sull’applicazione clinica della terapia genica della linea germinale, pur non escludendo una possibile revisione di questa posizione qualora fosse possibile garantire una serie di adeguate condizioni di sicurezza, efficacia, giustizia e accessibilità (Dichiarazione finale della Conferenza del CIOMS nel 1990, The ethical implications of gene therapy del 1994 nel contesto della Commissione Europea, il parere Terapia genica del CNB del 1991, per citarne alcuni).
In questo contesto si inserisce il testo della Convenzione di Oviedo (Convenzione sui diritti umani e la biomedicina del Consiglio d’Europa, 1997) che stabilisce che “Un intervento mirato a modificare il genoma umano può essere intrapreso solo per scopi preventivi, diagnostici o terapeutici e solo se la sua finalità non è quella di introdurre modificazioni nel genoma dei discendenti”, il che sembra non lasciare spazio a interpretazioni sulla possibilità di sviluppare la ricerca ai fini della “correzione” di difetti genetici degli embrioni prima dell’impianto.
Lo scandalo del caso Jiankui
Eppure nel 2018 il biofisico cinese He Jiankui ha annunciato su YouTube la nascita delle prime due gemelle “OGM” al mondo, note al pubblico coi nomi di fantasia Lulu e Nana. Secondo il progetto, il loro genoma avrebbe dovuto essere modificato in un sito specifico per riprodurre la delezione (eliminazione di una specifica sequenza di basi) sul gene responsabile dell’HIV che rende naturalmente immuni alla malattia, in modo da tutelarle dall’infezione, essendo il padre sieropositivo. Dai pochi dati rilasciati, tuttavia, sono immediatamente emerse una serie di problematiche prevedibili: la modificazione introdotta non corrisponde a quella inizialmente prevista e si tratta dunque di un’alterazione di cui non conosciamo le conseguenze a lungo termine. Inoltre, nel caso di Lulu, a differenza della sorella, la modificazione genetica non risulta essere presente in modo omogeneo in tutte le cellule, lasciando almeno una copia del gene non alterata e mantenendo così un potenziale rischio di infezione: tale condizione è riconducibile al fenomeno del mosaicismo. A questo si aggiunge poi il rischio di alterazioni off-target (si veda sopra) col rischio di innescare, ad esempio, una proliferazione tumorale ed effettivamente He ha dichiarato di averne individuata una innocua in maniera fortuita, il che porta a supporre che allo stesso modo se ne potrebbero individuare altre, magari più rischiose per la salute della bambina. Ancora più pericolose sono le macromutazioni on-target, ossia lesioni del DNA vicino al sito d’interesse dovute a errori nei processi di saldatura che seguono il taglio della sequenza genica e a cui gli embrioni sembrano essere particolarmente esposti.
Attualmente non si hanno informazioni sullo stato di salute delle due bambine, anche se pare che pochi mesi dopo ne sia nata una terza, di cui si sa ancora meno. He Jiankui è stato processato e condannato a tre anni di carcere perché considerato colpevole di «non aver avuto una corretta certificazione per praticare l’attività medica, e di aver deliberatamente violato le regole nazionali della ricerca scientifica e del trattamento medico nella ricerca deliberata di fama e denaro», secondo la corte di Shenzhen.
Le reazioni
Il caso ha attirato le critiche della quasi intera comunità scientifica internazionale, ma ha avuto l’esito positivo di incoraggiare una presa di posizione ufficiale da parte dell’OMS con la pubblicazione, il 12 luglio 2021, di un rapporto diviso in tre parti: “Un quadro per la governance”, “Raccomandazioni” e un “Position Paper”. L’OMS afferma con chiarezza che allo stato attuale è irresponsabile procedere con applicazioni cliniche dell’editing germinale ereditabile ed elenca nove raccomandazioni principali, tra cui la propria leadership scientifica e morale, il contrasto del cosiddetto ethics dumping (ossia lo spostamento della ricerca dove i controlli sono deboli), la promozione del dialogo con la cittadinanza sull’argomento, la creazione di meccanismi di segnalazione sicuri per fermare pratiche pericolose e abusive, l’elaborazione di registri globali pubblici per condividere ogni progresso in materia, oltre alla revisione periodica del documento. Da allora, tuttavia, non sono emerse novità rilevanti.
Conclusioni
Oltre all’imprevedibilità dei rischi per la salute, a destare profondo timore anche nella “gente comune” che viene a contatto con l’argomento, è il confine sfumato tra gene editing a scopo puramente terapeutico e a scopo, invece, di “potenziamento”, in uno scenario quasi apocalittico di “progettazione” di neonati con tratti selezionati. Tutto ciò evoca non sconosciuti programmi di eugenetica. Evitiamo, però, gli allarmismi: si tratta di una realtà lontana e improbabile, oltre che ostacolata da numerose normative a livello nazionale e internazionale. Recentemente, però, sono emerse informazioni incomplete riguardo ad un nuovo progetto, condotto da una startup californiana di nome “Preventive” e finanziato da alcuni magnati della Silicon Valley, che si propone di modificare embrioni destinati all’impianto al fine di creare bambini più protetti da malattie ereditarie (ma forse anche più intelligenti o più belli…). Per maggiori informazioni a riguardo, vi lascio il link all’articolo di Focus: .https://www.focus.it/scienza/salute/editing-genetico-di-embrioni-un-progetto-segreto-nella-silicon-valley
Ciò che, tuttavia, potrà risolvere queste preoccupazioni etiche o di altra natura, non è certo il rifiuto di approcciarsi a un tema puramente per paura dell’ignoto, poiché la mancanza di consapevolezza e di un contesto giuridico chiaro non contrasterà il corso inarrestabile del progresso. Chissà che, per una volta, non saremo noi a controllare la tecnica che produciamo invece di esserne travolti.